V súčasnosti je všeobecne uznávané, že včasné zahájenie chorobu modifikujúcej terapie (DMT) je spojené s lepšou dlhodobou prognózou. Otázka, kedy a ako deeskalovať alebo ukončiť DMT, však zostáva stále otvorená. O tejto problematike sa diskutovalo na workshope ECTRIMS v roku 2023, ktorého cieľom bolo poskytnúť praktické odporúčania založené na dôkazoch pre liečbu a sledovanie deeskalácie DMT, a je predmetom tohto prehľadu.
Cieľom DMT sa postupne stalo dosiahnutie úplnej kontroly nad zápalovou zložkou ochorenia, a nielen znižovanie frekvencie relapsov. Súčasné terapeutické algoritmy sa neustále zdokonaľujú, pričom je akceptované, že väčšie prínosy DMT v prevencii relapsov a oneskorenie progresie sa dosiahnu pri včasnom zahájení účinnej liečby. Výber DMT sa riadi hodnotením prínosov a rizík, ktoré je podporené diskusiou medzi eskaláciou a včasnými vysoko účinnými terapeutickými režimami.
Väčšina DMT pri SM sa podáva kontinuálne. Medzi tieto udržiavacie terapie patrí interferón-β (IFN-β), glatiramer acetát (GA), teriflunomid (TRF), dimethyl fumarát (DMF)/diroximel fumarát (DRF), ako aj „vysoko účinné terapie“ (HET), vrátane anti-CD20 protilátok a liečiv cielených na transport imunitných buniek, ako je natalizumab (NTZ) a modulátory sfingosín-1-fosfátového receptoru (S1PR). Alternatívou k týmto udržiavacím terapiám je podávanie HET buď jednorazovo, alebo sekvenčne, čím sa dá dosiahnuť vyššia adherencia k liečbe a nižšie riziko dlhodobých kumulatívnych nežiaducich účinkov, spojených s chronickou imunosupresiou. Do tejto kategórie, známej tiež ako imunitná rekonštitučná terapia (IRT), patrí kladribín (CLA), alemtuzumab (ALZ), mitoxantron (MTX) a autológna transplantácia krvotvorných kmeňových buniek (AHSCT).
Okrem optimálneho výberu DMT treba vytvoriť algoritmy deeskalácie, ktoré by odôvodňovali pravidelné prehodnocovanie liečebných plánov s cieľom znížiť intenzitu liečby, alebo ju dokonca ukončiť, pokiaľ sa pomer prínosu a rizika stane menej priaznivým. V tejto súvislosti je pochopenie zásad, problémov a vyvíjajúcich sa dôkazov, týkajúcich sa stratégií deeskalácie zásadné pre optimalizáciu dlhodobých výsledkov, zmiernenie rizík a zlepšenie kvality života osôb s SM. Doposiaľ však ohľadom stratégií deeskalácie alebo ukončenia liečby neexistuje zhoda.
Deeskalačné stratégie sa zvyčajne vzťahujú na prechod z jedného DMT na menej účinný, ale môže ísť aj o zníženie dávky alebo predĺženie dávkovacieho intervalu. Ukončenie DMT, či už trvalé alebo dočasné (napr. v čase tehotenstva), zdieľa s deeskalačnými stratégiami problémy s výberom pacientov a sledovaním. Stratégie deeskalácie platia pre všetky typy DMT. U imunitných rekonštitučných terapií (IRT) sa deeskalácia môže dokonca považovať za súčasť ich mechanizmu účinku, pretože sa očakáva, že navodí predĺženú remisiu bez ďalšej DMT alebo s menej účinnou udržiavacou liečbou.
Hlavným dôvodom pre zmenu alebo ukončenie DMT je zmena rovnováhy medzi prínosom a rizikom u daného pacienta. To môže súvisieť so znížením očakávanej účinnosti a/alebo zvýšením rizík spojených s liečbou alebo hostiteľom. V oboch prípadoch hrajú zásadnú úlohu zmeny imunitného systému súvisiace s vekom.
Imunosenescencia, inflamm-aging a ich význam pre SM
Imunosenescencia (ISe) a inflamm-aging (IA) predstavujú dva kľúčové procesy, spojené so starnutím, ktoré ovplyvňujú imunitné funkcie. ISe sa prejavuje postupným poklesom funkcie imunitného systému, najmä zmenami v T a B-lymfocytoch a protilátkach, zatiaľ čo IA je charakterizovaný chronickým nízkym stupňom zápalu. Tieto procesy môžu viesť k vyššej incidencii rakoviny a infekcií a zníženej odpovedi na očkovanie u starších jedincov. Ďalej sa ukazuje, že makrofágy/mikroglie CNS majú tendenciu diferencovať sa do prozápalového fenotypu, ktorý ovplyvňuje susedné bunky a prispieva k poškodeniu tkaniva. Stále viac dôkazov naznačuje, že na SM by sa malo nahliadať ako na kontinuum s rôznym podielom zápalových a neurodegeneratívnych procesov u jednotlivých osôb a v priebehu času.
Relapsy sú spojené s fokálnymi demyelinizačnými léziami, súvisiacimi s infiltráciou periférnych imunitných buniek (predovšetkým T a B buniek) cez hematoencefalickú bariéru (BBB). Počas progresívnej fázy je periférne imunitné postihnutie sekundárne k difúznemu a kompartmentalizovanému zápalu CNS, ktorému dominuje mikrogliálna aktivácia a meningeálna infiltrácia. Oba procesy korelujú s difúznou neuroaxiálnou stratou, ktorá je považovaná za hlavný podklad progresívneho postihnutia u SM. U pacientov s SM sa tak postihnutie môže rozvinúť buď v dôsledku zhoršenia súvisiaceho s relapsom, alebo progresie nezávislej od aktivity relapsu (PIRA). Nedávno sa ukázalo, že PIRA začína vo včasnej fáze ochorenia, a to aj u relaps-remitentnej formy (RR SM), a stáva sa hlavnou príčinou kumulácie postihnutia s rastúcim vekom a dĺžkou trvania ochorenia. ISe a IA teda môžu hrať úlohu tak v poklese fokálnej zápalovej aktivity a progresívnej neurodegenerácii pozorovanej s rastúcim vekom u pacientov s SM, ako aj v rozdielnej účinnosti a rizikách DMT.
Otázky týkajúce sa bezpečnosti
Vzhľadom na to, že všetky DMT ovplyvňujú imunitný systém, je najčastejším bezpečnostným problémom riziko infekcií. ALZ, AHSCT a intravenózne anti-CD20 prípravky sú v porovnaní s inými DMT spojené so zvýšenou frekvenciou závažných infekcií (tj. vyžadujúcich hospitalizáciu). Riziko infekcie u rituximabu (RTX) je významne spojené s vekom, stupňom postihnutia, obezitou, lymfopéniou, hypogamaglobulinémiou a dĺžkou liečby, pričom tieto faktory sú od seba nezávislé.
Hypogamaglobulinémia súvisí tiež s kumulatívnou dávkou intravenóznych B deplečných látok (RTX a OCR). Na druhej strane vyššie kumulatívne dávky RTX zvyšujú riziko infekcie aj v prípade normálnych hladín IgG. Celkovo sa ako najdôležitejší rizikový faktor pre závažné infekcie pri liečbe RTX ukázala miera postihnutia, čo je pravdepodobne relevantné aj pre ostatné anti-CD20 liečivá.
U starších pacientov, liečených NTZ, FTY (fingolimod) alebo DMF je zvýšené riziko oportúnnych infekcií, ako je progresívna multifokálna leukoencefalopatia (PML), spôsobená infekciou JC vírusom. Preukázaným rizikovým faktorom PML je tiež liečba NTZ dlhšia ako 2 roky. S vekom a dĺžkou liečby rovnako súvisí riziko kryptokokovej meningitídy pri liečbe FTY a vyššie riziko lymfopénie vyvolanej DMF a dlhším časom do repopulácie lymfocytov po ukončení liečby.
Odpoveď na vakcíny, vrátane vakcíny proti COVID-19, je oslabená niektorými DMT (modulátory S1PR, B deplečná terapia) a ku zníženej účinnosti vakcín môže rovnako prispievať ISe.
Celkový výskyt rakoviny je porovnateľný s výskytom v bežnej populácii, čo znamená, že sa zvyšuje s vekom. S vekom sa tiež zvyšuje sklon ku kumulácii komorbidít, ktoré môžu zvyšovať riziko interakcií medzi DMT a liečbou týchto komorbidít, ale aj špecifické riziká DMT.
Pre dlhodobé riziko sekvenčného užívania liekov s rôznymi mechanizmami účinku neexistuje dostatok dôkazov, aj keď nedávna štúdia nezistila žiadny významný vplyv predchádzajúcej expozície DMT na riziko infekcie RTX.
Potenciálne riziká deeskalácie liečby u SM
Rebound fenomén
Rebound fenomén (RF) zvyčajne označuje zvýšenie aktivity ochorenia po ukončení liečby DMT, doposiaľ však nemá jednotnú definíciu. Prejavuje sa zvýšením miery relapsov a/alebo aktivitou na MR. Niektorí autori navrhli dodatočné kritériá, ako sú závažné relapsy spojené s trvalým zvýšením EDSS, nové T2 lézie a gadolinium enhancujúce lézie na MR.
Prípady RF boli popísané po ukončení liečby DMT ovplyvňujúcej bunkový transport, ako je NTZ a FTY, pričom hlavným mechanizmom je rýchly návrat lymfocytov do CNS. Riziko RF po ukončení liečby inými modulátormi S1PR nie je dostatočne objasnené; doposiaľ bol zaznamenaný len jeden prípad po vysadení siponimodu.
Riziko zrychlenia progresie
Nedostatok informácií o dôvodoch ukončenia liečby a porovnateľných pacientov zostáva významnou limitáciou pre hodnotenie a výsledky štúdií sú protichodné.
Starší pacienti s SM
U starších pacientov s SM je relaps veľmi vzácny, ale je spojený s horšími výsledkami po relapse. Tento pokles schopnosti zotavenia môže byť spôsobený zníženou kapacitou remyelinizácie a neurodegeneratívnymi procesmi spojenými so starnutím.
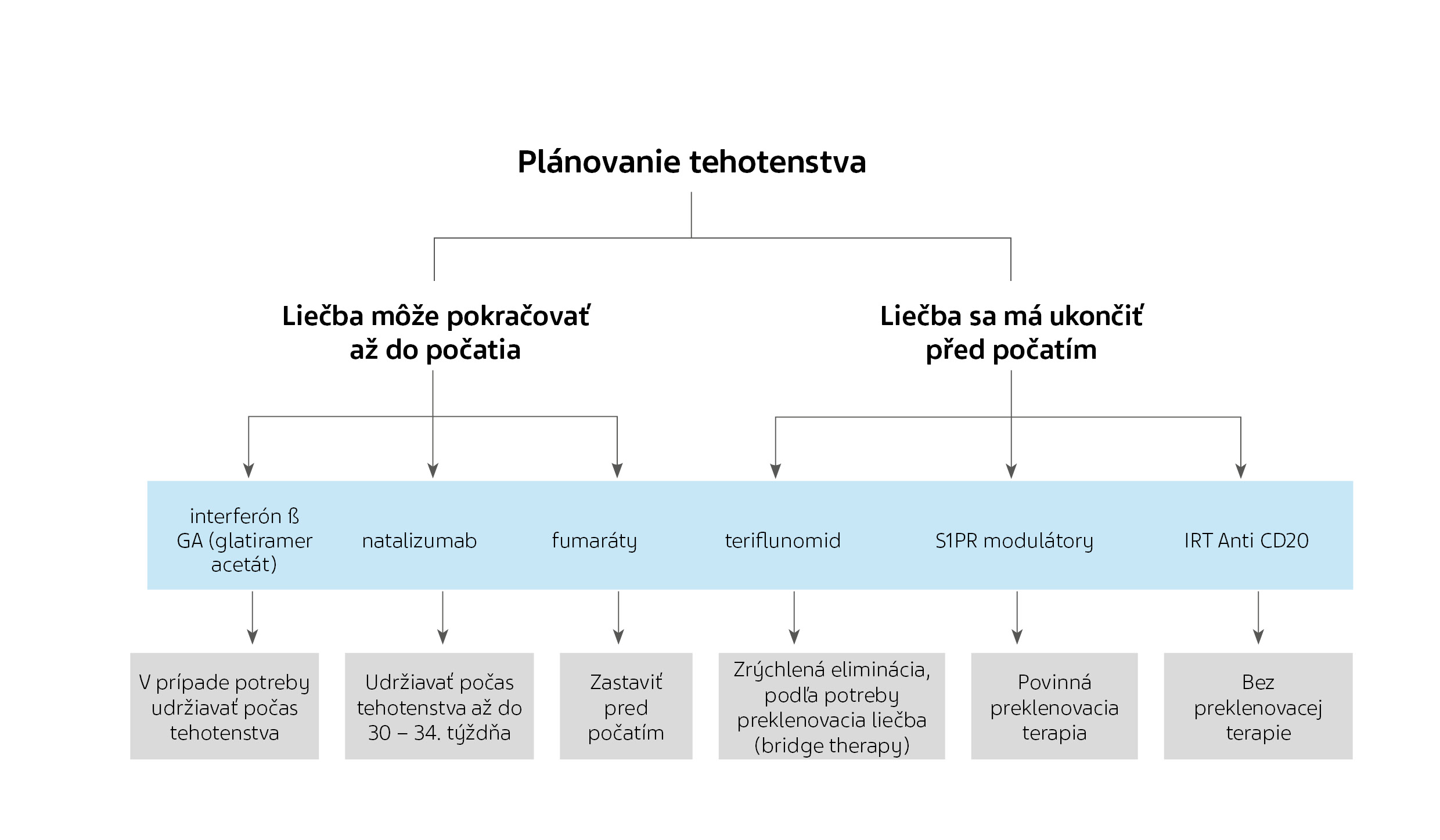
Dočasná deeskalácia spojená s plánovaným alebo prebiehajúcim tehotenstvom
Štúdie ukazujú, že miera relapsov počas tehotenstva klesá. Niektorí lekári majú tak tendenciu DMT pred počatím systematicky vysadzovať, iní DMT nezahajujú v prípade krátkodobého plánu tehotenstva. Ochranný účinok tehotenstva však nie je vždy dostatočný k tomu, aby zabránil reaktivácii ochorenia alebo dokonca RF, a to najmä u žien, ktoré prestanú užívať DMT ovplyvňujúce bunkový transport. Rozhodnutia o liečbe treba individualizovať, zdieľať ich s pacientkami a ich partnermi, a pokiaľ možno ich predvídať. Dôležité je, že každá voľba DMT pre ženu v plodnom veku musí zohľadniť jej plánovanie rodiny.
Stratégie deeskalácie v závislosti od typu DMT
Fingolimod a ďalšie modulátory S1PR
Fingolimod (FTY) a ďalšie modulátory S1PR predstavujú významné riziko relapsu alebo RF pri náhlom ukončení liečby. Z tohto dôvodu sú pacienti liečení FTY málo zastúpení v observačných štúdiach o ukončení liečby a boli vylúčení z klinickej štúdie STOP-I-SEP.
V štúdii Jouvenota a kol. u 64 pacientov starších ako 50 rokov, ktorí prestali užívať FTY bez prechodu na inú liečbu po najmenej 2 rokoch bez aktivity ochorenia, bol pomer rizika (HR) 4,5 pre relaps v roku po ukončení liečby v porovnaní so skupinou pokračujúcou v liečbe. Štúdia 685 pacientov z registra MS Base zistila, že prechod z FTY na základnú liečbu bol spojený s vyššou mierou relapsov ako prechod na HET. V observačnej štúdii 1 045 pacientov, ktorí prešli z FTY, bol ARR 0,67 pre OCR a 2,31 pre kladribín (CLA) v porovnaní s NTZ. Ako zaujímavá možnosť budúcej deeskalácie sa teda javí „preklenovacia“ liečba anti-CD20 látkami. Niektorí neurológovia navrhujú po ukončení podávania FTY podať jednorazovú infúziu OCR, aby sa predišlo riziku RF, ale v literatúre zatiaľ nie sú k dispozícii údaje, ktoré by túto stratégiu podporovali.
Náročným bodom je dĺžka wash-out obdobia. Riziko relapsu sa totiž výrazne zvyšuje po 2 mesiacoch vymývania; v štúdii Roose a kol. dokonca po 1 mesiaci. K preklenutiu wash-out obdobia boli navrhnuté vysoké dávky kortikosteroidov, najmä pokiaľ pretrvávajúca lymfopénia bráni zahájeniu inej liečby, ale táto stratégia nebola systematicky hodnotená. Niektorí autori navrhli postupné vysadenie fingolimodu s nahradením (alebo bez nahradenia) inou terapiou, avšak táto metóda doposiaľ nebola dostatočne zdokumentovaná.
Natalizumab
Ukončenie liečby NTZ bez prechodu na inú liečbu sa neodporúča, pretože je spojené s vysokou mierou relapsu alebo RF. Dokonca aj v kontexte stability ochorenia po dobu 2 rokov alebo dlhšie u osôb starších ako 50 rokov liečených NTZ bolo prerušenie liečby spojené s oveľa vyšším rizikom relapsu, a to v roku nasledujúcom po vysadení liečby v porovnaní so skupinou pokračujúcou v liečbe. Pokračovanie v liečbe NTZ s predĺženým intervalom dávkovania môže byť prijateľnou možnosťou pre pacientov negatívnych na anti-JCV protilátky alebo pozitívnych s indexom pod 0,9. Zdá sa totiž, že účinnosť na riziko relapsov zostáva zachovaná pri dávkovaní 6 týždňov s možným znížením rizika PML u anti-JCV pozitívnych pacientov s SM.
Stratégiu ukončenia liečby NTZ hodnotil systematický prehľad Sellnera a kol., kde sa IFN-β a GA ukázali ako nedostatočné v prevencii reaktivácie SM u väčšiny pacientov. DMF môže byť vhodnou voľbou pre pacientov s nízkou aktivitou ochorenia pred zahájením NTZ. Dáta o TRF ako stratégii ukončenia NTZ sú obmedzené. FTY bol najviac skúmanou terapiou po NTZ, pričom prechod na FTY bol spojený s nižším počtom relapsov ako pred zahájením NTZ. Prechod na anti-CD20 terapie, ako je RTX a OCR, vykázal veľmi nízke percento relapsov po ukončení NTZ. Dôkazy pre pulzy metylprednisolonu sú obmedzené.
Dĺžka wash-out obdobia kratšia ako tri mesiace je spojená s nižším rizikom relapsu. Protokol s postupným dávkovaním NTZ bol spojený s nižšou mierou relapsu v porovnaní s priamym prechodom na inú liečbu. Dôležité je tiež monitorovanie rizika PML u pacientov pozitívnych na JC vírus po ukončení NTZ.
Anti-CD20 látky
V retrospektívnej štúdii zahrňujúcej 92 pacientov s RR SM sa nezistilo, že ukončenie liečby RTX z akéhokoľvek dôvodu bolo spojené s rizikom RF alebo významným návratom aktivity ochorenia po 14 mesiacoch sledovania. Štúdia Jouvenot et al. ukázala, že riziko relapsu v roku po ukončení liečby RTX alebo OCR u pacientov starších ako 50 rokov bolo podobné ako u tých, ktorí v liečbe pokračovali. To naznačuje, že ukončenie liečby sa môže zvážiť u určitých pacientov, najmä tých, ktorí spĺňajú kritériá veku alebo stability ochorenia.
V súčasnosti najsľubnejšou stratégiou deeskalácie anti-CD20 je zníženie dávky a/alebo predĺženie intervalov medzi infúziami. Dôkazy naznačujú, že účinok intravenóznych anti-CD20 agens môže trvať oveľa dlhšie, ako sa doposiaľ predpokladalo. Otázka, kedy sa interval medzi infúziami môže predĺžiť na viac ako 6 mesiacov, však zostáva nevyriešená. Potenciálny prínos predĺžených dávkovacích intervalov pre plánovanie očkovania alebo tehotenstvo je zrejmý, pričom jedným z hlavných cieľov tejto stratégie je tiež zníženie rizika infekcií. V neposlednom rade sa nedá vylúčiť, že predĺženie dávkovacieho intervalu má negatívny vplyv na procesy spojené s progresiou SM.
Imunitná rekonštitučná terapia (IRT)
Na rozdiel od udržiavacej liečby sa IRT, medzi ktoré patria CLA, MTX, ALZ a AHSCT, aplikujú jednorazovo alebo v krátkych intermitentných cykloch. Cieľom IRT je eliminovať patogénny imunitný repertoár prostredníctvom intenzívnej krátkodobej imunosupresie alebo deplécie imunitných buniek a následne rekonštituovať nový imunitný systém s nádejou na obnovenie imunitnej tolerancie. Aj keď IRT znižujú riziko kumulatívnych nežiaducich účinkov, spojených s chronickou imunosupresiou, vystavujú pacientov väčšiemu množstvu rizík spojených s liečbou na začiatku liečby. Medzi včasné nežiaduce účinky patrí febrilná neutropénia a infekčné komplikácie, ktoré sú primárne spojené s pulznou imunosupresiou. Neskoré nežiaduce účinky zahrňujú rozvoj sekundárnych autoimunitných ochorení, najmä po terapii ALZ a AHSCT.
Deeskalácia je neoddeliteľnou súčasťou prístupu IRT, lebo udržanie remisie môže byť dosiahnuté po dlhý čas. Avšak aktivita ochorenia a progresia postihnutia sa môžu znovu objaviť, čo zdôrazňuje potrebu pravidelného klinického a zobrazovacieho sledovania. Podľa dát z kľúčových klinických štúdií dosiahlo po dvoch rokoch stav NEDA-3 (absencia relapsov, zhoršenie EDSS skóre a MR aktivita) len 58 % pacientov, liečených ALZ a 44 % pacientov, liečených CLA; avšak po AHSCT dosiahlo stav NEDA-3 60-90 % pacientov.
V súčasnosti existuje obmedzený konsenzus ohľadom manažmentu pacientov, ktorí po IRT vykazujú aktivitu ochorenia, vrátane opätovného nasadenia iné/nové DMT alebo opätovného nasadenia IRT. MTX sa teraz používa oveľa menej, avšak zostáva zaujímavou možnosťou ako indukčný liek (mesačne po dobu 6 mesiacov) pred dlhodobým podávaním iných bezpečnejších DMT u pacientov s vysoko aktívnou RR SM, najmä v krajinách s nízkymi príjmami.
Deeskalačná stratégia v závislosti od špecifických podmienok
Tehotenstvo
Rastúci počet dôkazov o expozícii liekom počas tehotenstva a dojčenia umožňuje lepšie posúdiť prínos a riziko pre matku aj plod a vydať odporúčania pre liečbu DMT v tomto kontexte.
Pokiaľ ide o problémy týkajúce sa plodu, nie je potrebné injekčnú liečbu prvej línie prerušovať pred počatím a môže sa v nej pokračovať aj počas tehotenstva. Fumaráty môžeme vzhľadom na ich veľmi krátky polčas a nedostatok dôkazov o teratogenite používať až do potvrdenia tehotenstva. Naopak, modulátory S1PR a TRF by mali byť pred počatím vysadené, pričom wash-out obdobie a závisí od každého konkrétneho lieku.
NTZ sa môžu podávať až do konca druhého trimestra (až do 30.-34. týždňa), ale počas tretieho trimestra môže NTZ zvyšovať riziko reverzibilných hematologických abnormalít u novorodencov.
Odporúčania EMA a FDA varujú pred tehotenstvom 6 až 8 mesiacov po poslednej infúzii anti-CD20. Pretože však OCR a RTX neprechádzajú placentárnou bariérou počas prvého trimestra a sú odstránené v priemere za 5 mesiacov, tehotenstvo by teoreticky mohlo byť mysliteľné 2 mesiace po poslednej infúzii. Vzhľadom na to, že rýchlosť ich eliminácie je rôzna, niektorí odporúčajú počkať 3 až 4 mesiace. Podobne u ofatumumabu (OFA) s polčasom rozpadu 16 dní by sa mohlo pokračovať až do potvrdenia tehotenstva. Hlavným rizikom je výskyt hematologických alebo imunologických účinkov (a potenciálne kontraindikácie pre živé vakcíny) u novorodencov vystavených pôsobeniu anti-CD20 látok počas strednej alebo neskorej fázy tehotenstva. V prípade IRT by mala byť posledná dávka CLA a ALZ podaná najmenej 6 mesiacov, resp. 4 mesiace pred počatím.
Pokiaľ ide o riziko reaktivácie SM u matky, modulátory S1PR by nemali byť vysadené bez náhradnej terapie. Anti-CD20 lieky sa javia ako zaujímavá "preklenovacia terapia". CLA zostáva možnosťou, pokiaľ nie je plánované tehotenstvo v krátkodobom horizonte. Menej účinné lieky, ako sú IFN/GA alebo fumaráty, sa môžu zvážiť, pokiaľ bola aktivita ochorenia pred počatím relatívne nízka. Táto stratégia bude pravdepodobne horšia ako HET, ale lepšia ako žiadna k prevencii relapsu. Pokiaľ sa v tehotenstve (do 30-34 týždňov) pokračuje v liečbe NTZ, odporúča sa predĺžiť interval medzi jednotlivými dávkami na každých 6-8 týždňov a liečbu obnoviť najneskôr 2 týždne po pôrode. Pokiaľ je liečba NTZ z akéhokoľvek dôvodu prerušená pred otehotnením, mala by byť zahájená preklenovacia liečba, najlepšie anti-CD20 prípravkom.
Opätovné zahájenie DMT po pôrode súvisí s problematikou dojčenia. Všeobecne by sa od dojčenia nemalo odrádzať, ale nie je zlučiteľné s opätovným zahájením perorálnej DMT (TRF, fumaráty, modulátory S1PR), čo sú malé molekuly, ktoré prechádzajú do mlieka.
Pre užívanie počas dojčenia sú oficiálne schválené len tri DMT: IFN-β, GA a OFA.
Monitoring deeskalácie u SM
Monitoring aktivity a progresie SM po deeskalácii vyžaduje systematický a multidimenzionálny prístup. V rámci štyroch RCT zameraných na deeskaláciu boli vybrané rôzne výstupy, ktoré zahrňujú klinické výsledky hodnotiace výskyt relapsov a neurologické postihnutie, rádiologické výsledky pomocou MR mozgu, biologické výsledky pomocou hladiny NfL v krvi a výsledky, súvisiace s pacientom, týkajúce sa kvality života, úzkosti, depresie a záťaže liečbou.
Všeobecné odporúčania pre monitorovanie pacientov by mali byť nezávislé od veku, dĺžky trvania ochorenia, fenotypu, závažnosti SM a typu DMT. Odporúča sa sledovať klinické výsledky hodnotiace výskyt relapsov a neurologické postihnutie, ideálne doplnené o pacientske výsledky. Pri deeskalácii sa odporúča základné MR mozgu a miechy. Frekvencia a dĺžka rádiologického sledovania by však mala byť prispôsobená každej situácii.
V posledných rokoch sa objavila snaha o využitie digitálnych prostriedkov v manažmente pacientov s SM, čo by mohlo umožniť sledovanie symptómov v prirodzenom prostredí pacienta. V kontexte monitorovania deeskalácie však tieto metódy vyžadujú ďalšie hodnotenie.
Biologické markery, ako je NfL, silne súvisia s aktivitou ochorenia a účinnosti liečby, ale ich vekovo závislý nárast môže obmedziť diagnostické využitie na individuálnej úrovni. Na druhej strane hladiny gliového fibrilárneho kyslého proteínu (GFAP) korelujú s progresiou ochorenia, a to v mozgovomiešnom moku aj v sére.
Záver a budúce smery
V priebehu života pacienta sa prirodzený priebeh SM mení, dochádza k menšiemu počtu relapsov a aktivite MR, ale zvyšuje sa riziko progresie. To isté platí pre pomer prínosu a rizika v súčasnosti dostupných DMT, ktorý sa s vekom stáva menej priaznivým a treba ho pravidelne prehodnocovať. Vek pacienta je preto najdôležitejším kritériom pre zvažovanie deeskalácie. Aj keď neexistuje zhoda, zdá sa, že hraničným vekom je najmenej 55 rokov a možno aj viac. Obozretná deeskalácia tiež vyžaduje, aby po dobu priemerne 5 rokov neboli prítomné žiadne klinické alebo rádiologické známky aktivity ochorenia. K potvrdeniu týchto prahových hodnôt sú potrebné výsledky ďalších randomizovaných štúdií.
Okrem všeobecných kritérií treba rozhodnutie prispôsobiť špecifickým faktorom každého pacienta, ako je jeho ochota, závažnosť postihnutia, komorbidity, stav JCV, hypogamaglobulinémia a ďalšie, ktoré môžu zvyšovať riziká liečby. V každom prípade by malo byť rozhodnutie výsledkom zdieľaného procesu medzi pacientami a lekármi.
Stratégia deeskalácie závisí predovšetkým od typu použitej DMT, najmä od jej potenciálneho rizika RF. Pribúda dôkazov podporujúcich stratégiu odstupňovania dávok u monoklonálnych protilátok. Boli navrhnuté aj ďalšie zaujímavé prístupy, ktoré sa v súčasnosti vyhodnocujú, ako napríklad použitie jedinej infúzie anti-CD20 po ukončení NTZ alebo modulátora S1PR, alebo použitie CLA ako výstupnej terapie u starších pacientov.
Neexistuje zhoda ohľadom povahy, frekvencie a dĺžky monitorovania po deeskalácii, okrem toho, že je to povinné. Deeskalácia nie je ukončením starostlivosti a pacienti by to tak nemali vnímať. Budúce úsilie by malo smerovať k posúdeniu dopadu deeskalácie DMT na bezpečnostné výsledky aj na progresii ochorenia, najmä na menej viditeľné parametre, ako je únava alebo kognitívne poruchy. V tomto kontexte by boli zvlášť zaujímavé biomarkery a hodnotenie pacientom, ktoré sa dá využiť v klinickej praxi.
Referencie:
Androdias G. Et al., De-escalating and discontinuing disease-modifying therapies in multiple sclerosis. Brain. 2024 Dec 21:awae409. doi: 10.1093/brain/awae409. Epub ahead of print. PMID: 39707906.